EQUILIBRIO EN SOLUCIONES ACUOSAS
CUARTO PERIODO
CONTENIDOS
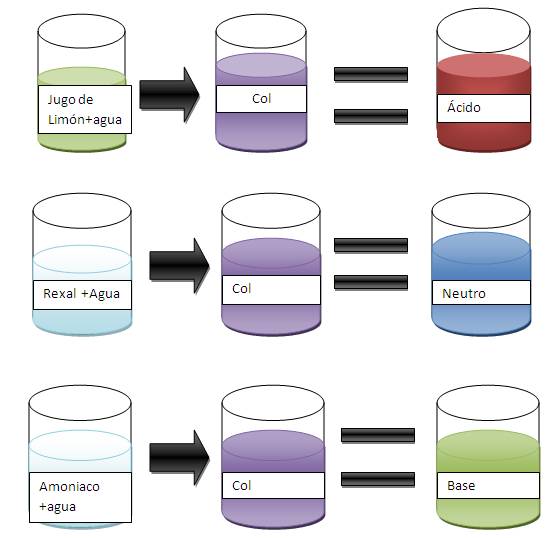
- Soluciones de electrolitos, acidos y bases
- Concepto experimentado de los acidos y las bases, según la teoría de:
- Arrehiuns
- Broasted-Lowy
- Lewis
- Equilibrio ionico del agua
- Ionizacion del agua, potenciación de hidrogeno o PH y concepto de POH
- Amortiguadores
- Reacciones quimicas que implican la utilizacion de acidos y bases
- Aplicacion de los aciods y las bases en la industria